¿Alguna vez te preguntaste de qué está hecho tu cuerpo?, tal vez, lo primero que se te venga a la mente sean los órganos -como el corazón, los riñones, el intestino o los pulmones- que trabajan en conjunto para que todo funcione correctamente.
Si vas un poco más allá, quizás podrías pensar en los diferentes tipos de células que lo componen. Pero si seguimos profundizando, descubrimos que, en su nivel más elemental, el cuerpo humano -al igual que todo lo que existe, vivo o inerte- está formado por átomos. Esos átomos, a su vez, suelen unirse y formar estructuras más complejas: las moléculas.

Aunque parezca increíble, lo que entendemos como vida surge de la interacción entre partículas diminutas que, por sí solas, no están vivas. Son millones de átomos organizados y combinados de distintas formas dentro de las células u organismos, los que hacen posible que existamos. Incluso aquello que consideramos más complejo, como la conciencia o el pensamiento, es el resultado de procesos químicos y eléctricos que ocurren entre estos componentes minúsculos. En última instancia, somos el producto de una danza constante entre átomos sin vida.
Es decir, los átomos y sus interacciones se constituyen como el nivel más elemental de la vida. A continuación, te contamos qué es un átomo, cuál es su estructura y te compartimos ejemplos para que puedas conocer mucho más a fondo la composición atómica, y descubrir su importancia.

👩🏻🏫 Definición del átomo
Un átomo es la unidad más pequeña de materia que conserva todas las propiedades químicas de un elemento. Vendría a ser el material fundamental que compone la materia.

Cuando hablamos de materia, nos referimos a todo aquello que tiene masa y ocupa un lugar en el espacio. Es decir, que todo aquello que existe y que forma parte del universo, es materia.
Toda la materia, desde una gota de agua o la hoja de un árbol, hasta un océano o una estrella, se encuentran constituidos por átomos, que se caracterizan por tener propiedades físicas y químicas particulares.
🟡 Partes del átomo
Esta pequeña unidad que forma la materia tiene dos regiones principales: una central y otra externa. En el centro se encuentra el núcleo, donde se agrupan dos tipos de partículas subatómicas:
- Los protones, que poseen carga positiva
- Los neutrones, que no tienen carga eléctrica.
Juntas, estas partículas reciben el nombre de nucleones.
Rodeando ese núcleo, en la parte externa del átomo, se encuentran los electrones, que tienen carga negativa y se mueven en distintas zonas alrededor del centro.
Los protones, neutrones y electrones son las piezas fundamentales que conforman la estructura del átomo. Lo que los distingue entre sí no es su presencia, sino el tipo de interacción y relación que mantienen entre ellos. Los electrones son los más livianos, con una masa muchísimo menor que la de los protones o los neutrones.
veces más que los electrones
En cuanto a su carga, los electrones poseen una carga negativa, considerada como la unidad básica o elemental de carga. Los protones, en cambio, tienen una carga igual en magnitud, pero positiva, mientras que los neutrones se caracterizan por ser eléctricamente neutros, es decir, no tienen carga.
La cantidad de protones presentes en el núcleo es lo que identifica a un átomo como perteneciente a un elemento específico. Por su parte, el número de electrones que lo rodean influye en los tipos de reacciones químicas en las que ese átomo puede intervenir.
Aunque los protones, neutrones y electrones se consideran las unidades básicas del átomo, cada uno de ellos está compuesto también por partículas aún más elementales, como los quarks y los leptones.
Estas son algunas de las características principales de las partículas subatómicas:
| Partícula | Zona del átomo | Carga eléctrica | Masa relativa | Función principal |
|---|---|---|---|---|
| Protón | Núcleo | Positiva (+1) | 1 (unas 1.836 veces más que un electrón) | Determina el número atómico y define el elemento |
| Neutrón | Núcleo | Neutra (0) | 1 (similar al protón) | Aporta masa y estabilidad al núcleo atómico |
| Electrón | Nube electrónica / corteza | Negativa (–1) | ~1/1.836 (muy ligera) | Interviene en las reacciones químicas y enlaces |
Tabla comparativa de partículas subatómicas.
Lo que mantiene unido a un átomo es una combinación de fuerzas eléctricas muy potentes que actúan entre sus partículas subatómicas, ya sean protones, electrones o neutrones.

🥼 Estructura del átomo
En condiciones normales, un átomo neutro contiene igual cantidad de protones en su núcleo que de electrones girando a su alrededor, lo que genera un equilibrio entre sus cargas positivas y negativas. Sin embargo, durante ciertas reacciones químicas o al interactuar con otras partículas, un átomo puede perder o ganar electrones. Cuando eso sucede, deja de ser neutro y se transforma en un ion. Si pierde electrones, adquiere una carga positiva; si gana electrones, se convierte en un ion con carga negativa. ¡Descubrí qué son los isótopos!
Las partículas subatómicas como protones, neutrones y electrones son diminutas en comparación con el tamaño total del átomo. De hecho, más del 99% del volumen de un átomo está compuesto por espacio vacío. ¡Esto significa que la materia, en su estructura más básica es "hueca"!
🧪 Ejemplos atómicos
En la naturaleza podemos encontrar más de 90 tipos de átomos diferentes, y cada uno da origen a un elemento químico único. Un elemento está formado únicamente por átomos de un solo tipo. Por ejemplo, el calcio está compuesto solo por átomos de calcio, y el argón únicamente por átomos de argón. Si preferís estudiar a distancia, podés tomar clases con un profesor de quimica online.
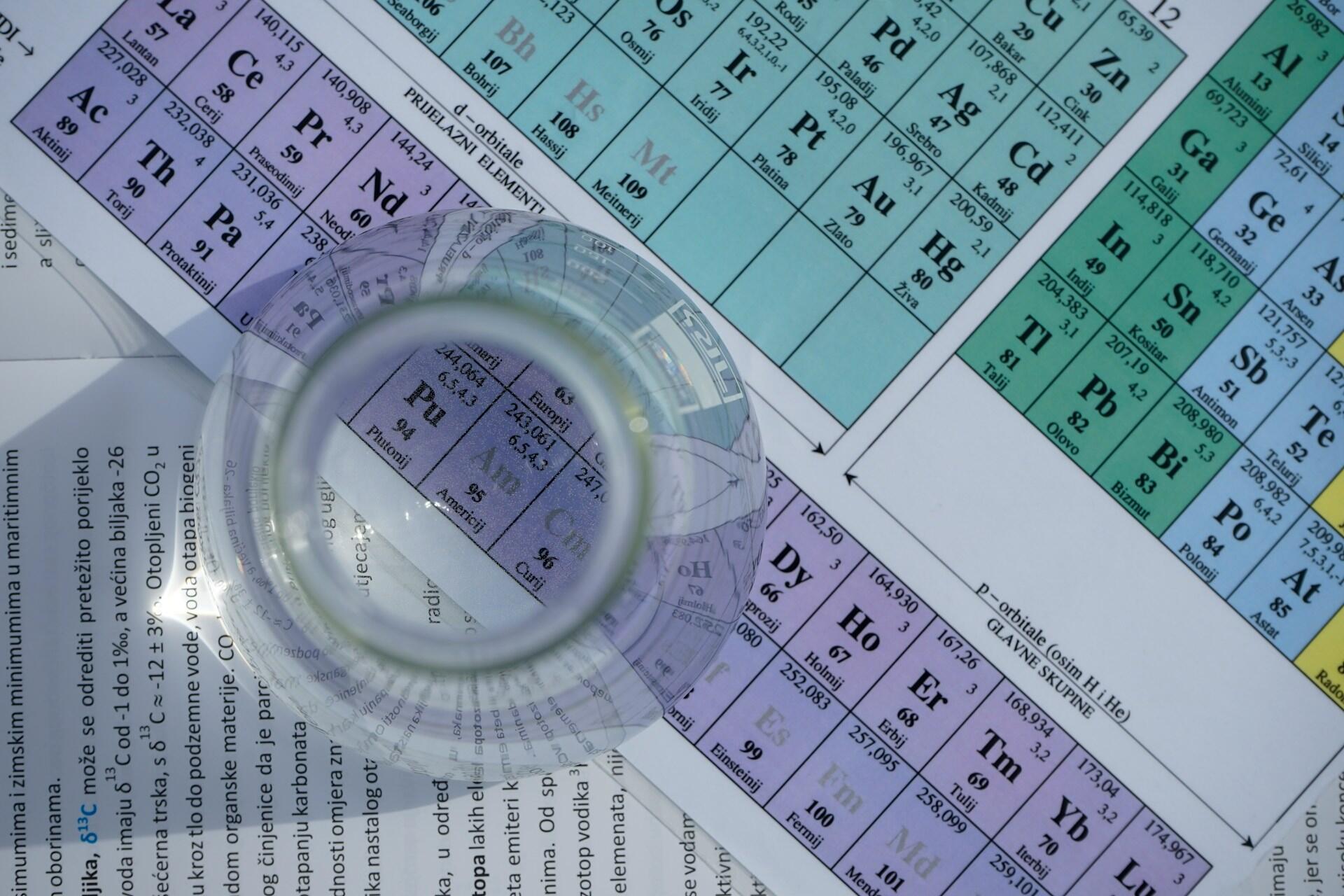
Estos elementos se organizan en la famosa y temida tabla periódica, un sistema químico que clasifica a los átomos según su número atómico, es decir, la cantidad de protones que poseen dentro de su núcleo.
Así, un átomo de magnesio que tiene 12 protones en su área nuclear, ocupa el lugar número 12 en la tabla periódica.
En los átomos con carga neutra, la cantidad de electrones es igual a la de los protones. Esto significa que el número atómico también nos indica cuántos electrones contiene un átomo. Las disposición de esos electrones, distribuidos en distintas capas alrededor del núcleo, es lo que define cómo se relaciona ese átomo con los demás. ¿Cuál es la estructura de la materia?
👩🔬 Comportamiento químico del átomo
Por eso, la capa más externa, denominada capa de valencia, es clave para poder entender el comportamiento químico atómico. Si esa capa está completa, el átomo tiende a ser químicamente estable, con poca inclinación a formar compuestos. En cambio, si le faltan electrones para llenarla, o si tiene electrones de más, el átomo buscará ganar, perder o compartir electrones para alcanzar la estabilidad. Esta necesidad de completar su capa de valencia es lo que mueve a los átomos a interactuar con otros y a formar enlaces químicos. Si querés profundizar y practicar estos conceptos, podés buscar clases de quimica.
Además, los átomos que comparten las misma cantidad de electrones en su capa externa suelen juntarse para formar moléculas o comportarse de manera parecida en sus reacciones químicas. Por ejemplo, litio, sodio y potasio tienen un solo electrón en su capa de valencia y presentan propiedades químicas similares.
A continuación, te compartimos algunos átomo ejemplos. Recordá que para ampliar información, siempre podés recurrir a la tabla periódica para conocer en detalle las propiedades de cada elemento.
| Elemento (átomo) | Símbolo | Número atómico | Grupo | Periodo | Tipo | Dato interesante |
|---|---|---|---|---|---|---|
| Hidrógeno | H | 1 | 1 | 1 | No metal | Es el elemento más ligero y abundante del universo. |
| Helio | He | 2 | 18 | 1 | Gas noble | Aunque está en el grupo 18, solo tiene 2 electrones. |
| Carbono | C | 6 | 14 | 2 | No metal | Base de la vida: forma millones de compuestos |
| Oxígeno | O | 8 | 16 | 2 | No metal | Indispensable para la respiración celular. |
| Sodio | Na | 11 | 1 | 3 | Metal alcalino | Muy reactivo; se encuentra en la sal de mesa (NaCl). |
| Cloro | Cl | 17 | 17 | 3 | No metal (halógeno) | Se usa en desinfección y en compuestos como el PVC. |
| Calcio | Ca | 20 | 2 | 4 | Metal alcalinotérreo | Importante para huesos y contracción muscular. |
| Hierro | Fe | 26 | 8 | 4 | Metal de transición | Esencial en la sangre (hemoglobina) y estructuras metálicas. |
| Cobre | Cu | 29 | 11 | 4 | Metal de transición | Excelente conductor eléctrico. |
| Uranio | U | 92 | Actínidos | 7 | Metal radiactivo | Se usa como combustible nuclear. |
Si te resulta un tema difícil de entender, te invitamos a que no te rindas. La química aborda temas complejos que en una primera instancia, o si no están bien explicados, pueden parecer imposibles. Sin embargo, un buen enfoque de enseñanza puede cambiar tu relación con la química para siempre, mostrándote su lado vivo, entretenido e interesante.
Para ello, te recomendamos tomar clases con nuestros profesores particulares de química. Contamos con una amplia cartilla de docentes distribuidos en las diferentes ciudades de Argentina, que se encuentran disponibles para acompañarte en tu tránsito por estos y otros contenidos químicos, mostrándote la magia que hay en cada uno. Por ejemplo, si vivís en San Miguel de Tucumán, podés encontrar una profesora de quimica.
Resumir con IA















