¿Sabías que los átomos están en todas partes? Todo lo que nos rodea, desde el aire, el agua, las plantas o incluso nuestro propio cuerpo, se encuentran constituidos por átomos. Estos vendrían a ser la materia prima elemental o los ladrillos que construyen el universo. Se dice que el átomo es la unidad más pequeña de materia que conserva todas las propiedades químicas de un elemento.
Sin embargo, así como todo lo que existe, estos átomos o ladrillos, también pueden presentar variaciones entre ellos, o versiones diferentes de sí mismos. A esas versiones se las conoce como isótopos.
Si la palabra te suena complicada o la química te da dolor de cabeza, estás en el lugar indicado. Seguí leyendo para poder entender de forma clara y con explicaciones sencillas qué son los isótopos, por qué existen y para qué sirven, así como para acceder a ejemplos concretos relacionados con la medicina y otras aplicaciones prácticas en las que los isótopos ocupan un rol. Además, si necesitás apoyo personalizado, podés buscar un profesor de química secundaria que te guíe según tu nivel.

🟢 Estructura atómica
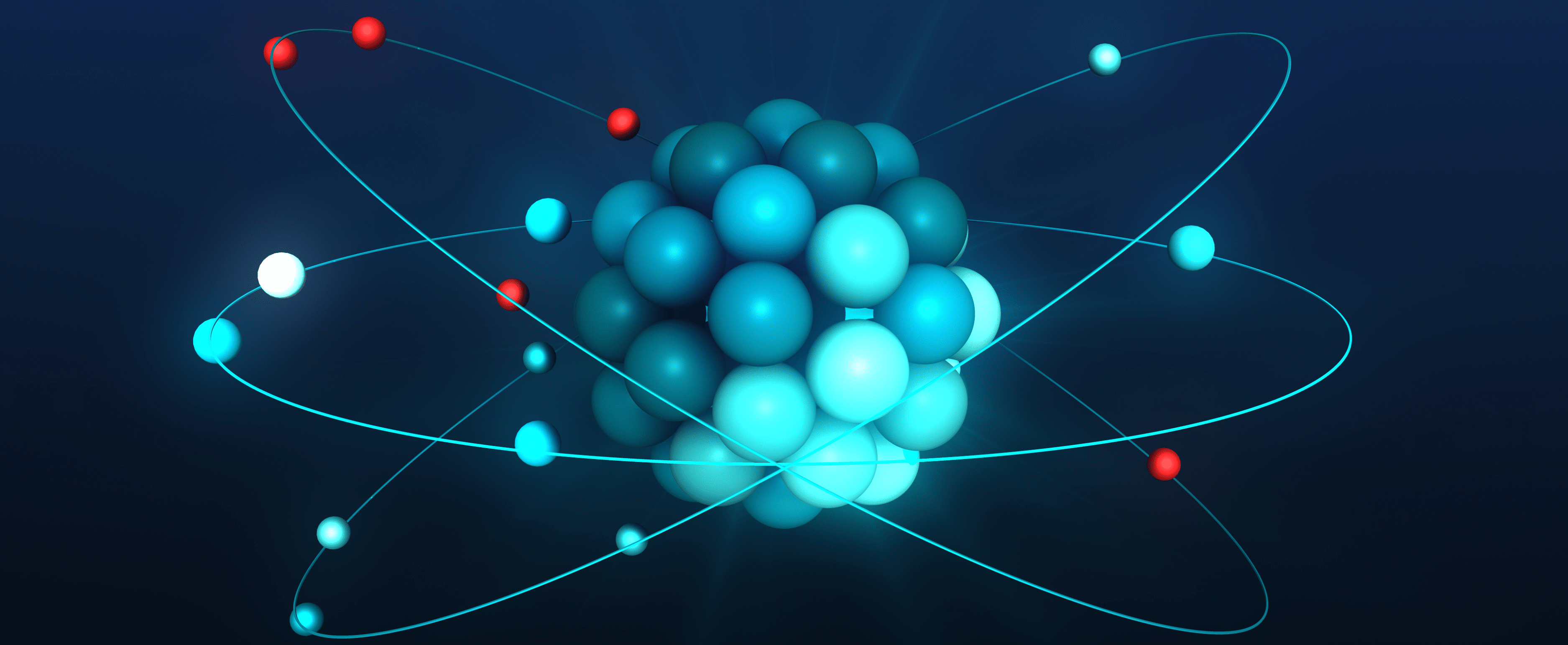
Para poder entender qué son los isótopos, primero veamos un poco sobre la constitución atómica. Cada átomo se encuentra formado por dos regiones: un núcleo y una zona externa.
Dentro del núcleo se alojan los neutrones y los protones, dos tipos de partículas que forman el átomo y que se las denomina partículas subatómicas. Además, en la región externa se encuentran un tercer grupo de partículas subatómicas llamadas electrones, que giran en diferentes direcciones alrededor del núcleo atómico.
Para que un átomo forme parte de un elemento químico en particular, tiene que tener una cantidad exacta de protones y electrones. La cantidad de protones que hay en el núcleo se llama número atómico, y ese número es el que se usa para ubicar a cada elemento en la tabla periódica.

Es una herramienta que organiza todos los elementos químicos conocidos de forma ordenada, según ciertas características que comparten. Sirve para comprender la estructura de la materia, saber cómo es un elemento, predecir cómo puede reaccionar con otros, estudiar cómo se relacionan entre sí, entre otras aplicaciones.
Cada casillero de esta tabla representa un elemento químico, como el hidrógeno, el oxígeno, el hierro o el hierro. Estos elementos están ordenados principalmente por:
- Su número atómico: la cantidad de protones del átomo en su núcleo.
- Sus propiedades químicas: elementos con comportamientos parecidos se encuentran ubicados en la misma columna (por ejemplo, todos los gases nobles están juntos).
¿Sabés qué son los electrones?
🟡 ¿Qué son los isotopos?
Sin embargo, la cantidad de neutrones dentro de un átomo sí que puede variar, y eso es lo que da lugar a los isótopos. Etimológicamente, esta palabra deriva del griego isos, que significa lo mismo, y tópos, cuyo significado es lugar. Esto hace referencia al hecho de que estos átomos comparten el mismo lugar en la tabla periódica, ya que pertenecen al mismo elemento, aunque con masas diferentes.
Son diferentes versiones de un mismo elemento químico, que tienen igual cantidad de protones, pero distinto número de neutrones en su núcleo.
La mayoría de los elementos químicos poseen más de un isótopo. Todos los isótopos de un elemento suelen tener un comportamiento químico prácticamente idéntico, pero pueden variar en cuanto a sus propiedades físicas, como por ejemplo, el peso del átomo. ¿Te gustaría aprender qué es una molécula?
🟠 Tipos de isótopos
En cuanto a estas diferencias físicas, podemos encontrar dos grandes grupos de isótopos: los que emiten radiación, denominados "isótopos radiactivos" o "inestables" y los que no emiten radiación, llamados "isótopos estables".
Isótopos radiactivos o inestables
Los isótopos radiactivos, inestables o radioisótopos, son versiones de elementos cuyo núcleo no es estable porque tiene un desequilibrio entre la cantidad de protones y neutrones que aloja. Debido a que el núcleo tiende a la estabilidad, libera energía y pequeñas partículas en un proceso que se llama desintegración radiactiva.
La energía liberada se puede detectar con aparatos especiales como el contador Geiger, que en contacto con la radiación emite un sonido o señal, o incluso con una película fotográfica que se oscurece al estar cerca de la radiación.
Cada isotopo radiactivo tiene su propio tiempo de desintegración, que se denomina período de semidesintegración o semivida: es el tiempo en que un elemento tarda en perder la mitad de su radiactividad.
La energía que emana el núcleo puede aparecer en distintas formas, como rayos alfa (núcleos de helio de 2 protones y 2 neutrones), rayos beta (son átomos cuyos electrones son muy rápidos), o rayos gama (es un tipo de radiación parecida a los rayos X, pero con más energía). Varios isótopos inestables tienen aplicaciones dentro de un amplio número de rubros como medicina, farmacología, agricultura, arqueología, tecnología, entre otros.
Isótopos estables
Los isótopos estables son diferentes versiones de un mismo elemento que tienen igual cantidad de protones, pero distinto número de neutrones. A diferencia de los radiactivos, estos no emiten radiación debido a que sus núcleos son estables y no cambian con el paso del tiempo. Si preferís clases presenciales en la costa, podés contactar a una profesora de quimica especializada.

Esto significa que su estructura interna permanece igual, sin descomponerse ni liberar energía. La mayoría de los isótopos que existen de forma natural en nuestro plantea son de este tipo. ¿Cuál es la estructura de la materia?
🔵 Ejemplos de isotopos
Algunos casos de elementos que tienen el mismo número de protones, pero que presentan esta variación en el número de neutrones en su núcleo son:
Uranio
El uranio es un metal que puede encontrarse en rocas y que se suele utilizar como fuente de energía nuclear. El tipo más común es el que tiene 92 protones y 146 electrones, denominado Uranio-238. Su isótopo, el Uranio-235, tiene 92 protones y 143 neutrones y suele utilizarse en centrales nucleares debido a que se puede dividir fácilmente y liberar una gran cantidad de energía.
Oxígeno
El oxígeno más frecuente en la naturaleza, denominado Oxígeno-16, aquel que respiramos y el que está en el agua (H₂O), tiene 8 protones y 8 neutrones. Sin embargo, también existen otras variantes, como el oxígeno-17 -que tiene 8 protones y 9 neutrones-, y el Oxígeno-18 -con 8 protones y 10 neutrones-. Estos isótopos de oxígenos son utilizados frecuentemente para realizar estudios del clima del pasado debido a que analizando este elemento en los fósiles marinos o en el hielo de los glaciares, es posible saber cómo era la temperatura y la composición ambiental hace miles de años.
Carbono
El carbono usual, que está en nuestro cuerpo y en las plantas cuenta con 6 protones y 6 neutrones y se llama Carbono-12. Además existen sus isótopos: una versión con 6 protones y 7 neutrones y otra con 6 protones y 8 neutrones. A la primera se la denomina Carbono-13 y a la segunda Carbono-14. Este último es muy utilizado en arqueología, ya que con el paso del tiempo emite una pequeña cantidad de radiación que permite estimar el paso de los años para calcular la antigüedad de restos orgánicos.
Hidrógeno: El hidrógeno más común tiene 1 protón y 0 neutrones. Sin embargo, también existe una variación de este elemento, con 1 protón y 2 neutrones. Por ser radiactivo, se utiliza en investigaciones científicas y en tecnología nuclear.
Yodo: El Yodo-127, con 53 protones y 74 neutrones, es el más frecuente en la naturaleza. Sin embargo, también existe una variación de este elemento que cuenta con 53 protones y 78 neutrones. A esta se la llama Yodo-131 que es radiactivo.
Es un elemento ampliamente utilizado en medicina, ya permite hacer estudios de tiroides y de algunos tipos de cáncer, entre otros usos.
A continuación, te compartimos una tabla comparativa con la información resumida de cada uno de estos elementos y sus isótopos:
| Elemento | Isótopo | N.º atómico (protones) | N.º de neutrones | ¿Es el más usual? | Tipo de isótopo |
|---|---|---|---|---|---|
| Carbono | Carbono-12 | 6 | 6 | ✅ Sí | Estable |
| Carbono-13 | 6 | 7 | ❌ No | Estable | |
| Carbono-14 | 6 | 8 | ❌ No | Radiactivo | |
| Oxígeno | Oxígeno-16 | 8 | 8 | ✅ Sí | Estable |
| Oxígeno-17 | 8 | 9 | ❌ No | Estable | |
| Oxígeno-18 | 8 | 10 | ❌ No | Estable | |
| Uranio | Uranio-238 | 92 | 146 | ✅ Sí | Radiactivo |
| Uranio-235 | 92 | 143 | ❌ No | Radiactivo | |
| Hidrógeno | Hidrógeno-1 | 1 | 0 | ✅ Sí | Estable |
| Deuterio (H-2) | 1 | 1 | ❌ No | Estable | |
| Tritio (H-3) | 1 | 2 | ❌ No | Radiactivo | |
| Yodo | Yodo-127 | 53 | 74 | ✅ Sí | Estable |
| Yodo-131 | 53 | 78 | ❌ No | Radiactivo |
Como verás, los isótopos son sumamente importantes, no solo en química, sino también en otras disciplinas. Si estás teniendo dificultades para aprender este u otros contenidos químicos, no dudes en recurrir a clases particulares con nuestros profesores. Contamos con una amplia cartilla de docentes que ofrecen cursos presenciales en las diferentes ciudades de Argentina, así como con opciones de clases a distancia para aquellos que desean aprender desde la pantalla.
Cualquiera sea tu preferencia, solo tenés que ingresar a nuestra plataforma online para descubrir los perfiles de los profesores que se ajustan a tus requisitos de búsqueda. Además, la primera hora de clase es gratis con la mayoría de nuestros docentes, por lo que podrás tener un espacio para conocer al profe y contarle cuáles son tus necesidades y objetivos antes de empezar con las clases. Por ejemplo, podés encontrar una profesora de quimica en La Plata entre las opciones disponibles.
Resumir con IA















